TopPage巚峫偺柪媨丂乽kothimaro丂Aruki乿偺尋媶幒傊栠傞
擬椡妛偺撲乽埑椡亊懱愊=婥懱検亊婥懱掕悢亊愨懳壏搙乿偺巇慻傒
嘥.棟憐婥懱偺忬懺曽掱幃
丂棟憐婥懱偺忬懺曽掱幃偼
pV=nRT丂(p=埑椡[pb]丒V=懱愊[m3]丄n=婥懱偺検[mol]丄R=婥懱掕悢[8.31J/molK]丄T=愨懳壏搙[K])
偱偡丅偙傟傪尵梩偱昞尰偟傑偡丅
嘆愨懳壏搙傪堦掕偵曐偪側偑傜(巄偔抲偄偰偍偒奜晹偲摨偠壏搙偵偡傞偙偲)丄埑椡p傪2攞偵偡傞偲懱愊V偼1/2攞偲側傝傑偡丅媡偵丄懱愊V傪2攞偵偡傞偲埑椡p偼1/2攞偲側傝傑偡丅
嘇扐偟丄奜晹偲抐擬偟偰懱愊V傪1/2攞偵偡傞偲愨懳壏搙偑忋徃偟丄抐擬偟偰懱愊V傪2攞偵偡傞偲愨懳壏搙偑壓崀偟傑偡丅偙傟傪乽抐擬曄壔乿偲尵偄傑偡丅
嘊婥懱棻巕偺1屄偺幙検偑2攞傗1/2攞偲側偭偰傕丄埑椡p傕懱愊V傕愨懳壏搙T傕曄壔偟傑偣傫丅
嘋婥懱棻巕偺屄悢(n[mol])偑2攞偵側傞偲pV偺抣偑2攞偲側傝丄1/2攞偲側傞偲pV偺抣偼1/2攞偲側傝傑偡丅
嘍愨懳壏搙T偑2攞偵側傞偲pV偺抣偑2攞偲側傝丄1/2攞偲側傞偲pV偺抣偼1/2攞偲側傝傑偡丅
嘦.儃僀儖偺朄懃

丂埲壓丄嘆偐傜嘍偲側傞巇慻傒傪峫嶡偟傑偡丅
丂愭偢丄嘆偐傜偱偡丅婥懱傪擖傟傞梕婍傪丄1曈b[m]偺惓榋柺懱偲偟傑偡丅婥懱偺検偼n[mol]偲愨懳壏搙T偼堦掕偲偟傑偡丅偙偺帪偺婥懱偺懱愊偼b3[m3]偱偡丅
丂婥懱暘巕1屄偑堦掕壏搙偱忈奞暔偑柍偄拞傪恑傓帪丄偦傟偼廃傝偺壏搙傛傝塣摦僄僱儖僊乕傪庴偗庢傝丄偳傫偳傫壛懍偟傑偡丅
 丂偦傟偵斾傋偰丄惓榋柺懱偺拞偺枾晻偝傟偨婥懱暘巕偼丄懠偲傇偮偐傝側偑傜忋壓嵍塃慜屻偵寖偟偔堏摦偟傑偡丅婥懱暘巕摨巑偑旕抏惈徴撍偡傞偺偱丄婥懱暘巕偑帩偭偰偄偨椡妛揑僄僱儖僊乕偺堦晹偼丄擬僄僱儖僊乕偵曄傢傝傑偡丅偦偟偰丄幐傢傟傞椡妛揑僄僱儖僊乕偼徴撍帪偺懍搙偺2忔偵斾椺偟偰懡偔側傝傑偡丅
丂偦傟偵斾傋偰丄惓榋柺懱偺拞偺枾晻偝傟偨婥懱暘巕偼丄懠偲傇偮偐傝側偑傜忋壓嵍塃慜屻偵寖偟偔堏摦偟傑偡丅婥懱暘巕摨巑偑旕抏惈徴撍偡傞偺偱丄婥懱暘巕偑帩偭偰偄偨椡妛揑僄僱儖僊乕偺堦晹偼丄擬僄僱儖僊乕偵曄傢傝傑偡丅偦偟偰丄幐傢傟傞椡妛揑僄僱儖僊乕偼徴撍帪偺懍搙偺2忔偵斾椺偟偰懡偔側傝傑偡丅
丂偱偡偐傜丄枾晻偝傟偨婥懱暘巕偼丄愨懳壏搙T偵墳偠偨堦掕懍搙傪曐偪傑偡丅
丂偲偙傠偱
嘐椡F=ma丂(m=暔幙偺幙検[噑]丒a=壛懍搙[m/s2])
嘑暔幙偺堏摦嫍棧r=(1/2)at2丂(t=帪娫[s])
嘒暔幙偺懍搙v=at
丂屘偵
嘓僄僱儖僊乕E=(1/2)mv2
偱偡丅
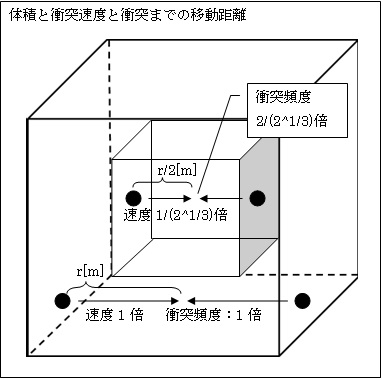 丂偙偙偱丄惓榋柺懱偺梕婍偺懱愊傪1/2攞偵偟傑偡丅偡傞偲丄婥懱暘巕偑懠偲徴撍傑偱偵堏摦偡傞嫍棧傕1/2攞偲側傝傑偡丅婥懱暘巕偺枾搙偑2攞偲側傞偺偱丄徴撍偡傞妋棪傕2攞偲側傞偐傜偱偡丅
丂偙偙偱丄惓榋柺懱偺梕婍偺懱愊傪1/2攞偵偟傑偡丅偡傞偲丄婥懱暘巕偑懠偲徴撍傑偱偵堏摦偡傞嫍棧傕1/2攞偲側傝傑偡丅婥懱暘巕偺枾搙偑2攞偲側傞偺偱丄徴撍偡傞妋棪傕2攞偲側傞偐傜偱偡丅
丂偙偺帪丄婥懱暘巕偺堏摦懍搙偼壗攞偲側傞偱偟傚偆偐丅寢榑偐傜尵偊偽1/(21/3)攞偵側傝傑偡丅
丂婥懱暘巕摨巑偑徴撍偣偢帩偭偰偄傞椡妛揑僄僱儖僊乕傪幐傢側偗傟偽丄嘑傛傝嫍棧偑1/2攞偲側傞偲丄帪娫偼1/併(2)攞偵丄嘒傛傝懍搙傕1/併(2)攞偲側傝傑偡丅
丂偙傟偱丄堏摦嫍棧偑1/2攞偲側傝堏摦懍搙偑1/(21/3)攞偲側偭偨偺偱
徴撍傑偱偵梫偡傞帪娫t=嫍棧r亐懍搙v=1/2亐1/(21/3)攞=(21/3)/2攞
偱偡丅屘偵
婥懱暘巕摨巑偺徴撍昿搙p'[夞/s]=1亐(21/3)/2=2/(21/3)攞
偱偡丅
丂尦偺梕婍偱偼
嘓婥懱暘巕摨巑偑徴撍偡傞僄僱儖僊乕U=m亊v2亊徴撍昿搙p=m亊12亊1=m[J]
偱偟偨丅偦偟偰丄梕婍偺懱愊偑1/2攞偵側傞偲
嘔婥懱暘巕摨巑偑徴撍偡傞僄僱儖僊乕U'=m亊v'2亊徴撍昿搙p'=m亊1/(22/3)亊2/(21/3)=m亊2/(23/3)=m[J]
偱偡丅偙偺條偵丄壏搙傪堦掕偵偟偰婥懱偺懱愊傪曄壔偝偣偰傕丄婥懱偺桳偡傞撪晹僄僱儖僊乕U偼曄壔偟傑偣傫丅偱偡偐傜丄戝偒偄梕婍偱偁傠偆偲彫偝側梕婍偱偁傠偆偲丄梕婍偺撪柺慡懱偱婥懱偐傜庴偗傞埑椡偼摨偠偱偡丅
丂偱偼丄婥懱暘巕摨巑偺徴撍偱幐傢傟傞椡妛揑僄僱儖僊乕偼壗攞偵側傞偱偟傚偆偐丅
丂幐傢傟傞椡妛揑僄僱儖僊乕偼丄婥懱暘巕偺徴撍帪偺懍搙偺2忔偵斾椺偟傑偡丅偦偟偰丄徴撍昿搙偵斾椺偟傑偡丅偟偨偑偭偰丄尦偺梕婍偱偼
幐傢傟傞椡妛揑僄僱儖僊乕E=12亊1=1攞
丂偦偟偰丄1/2攞偺懱愊偲側偭偨梕婍偱偼
幐傢傟傞椡妛揑僄僱儖僊乕E=1/(22/3)亊2/(21/3)=2/(23/3)=1攞
偱偡丅偙偺條偵丄懱愊傪曄壔偝偣偰傕徴撍偵傛傝幐傢傟傞椡妛揑僄僱儖僊乕偼摨偠偱偡丅
 丂偱偼丄偙偺帪埑椡p偼壗攞偲側傞偱偟傚偆偐丅
丂偱偼丄偙偺帪埑椡p偼壗攞偲側傞偱偟傚偆偐丅
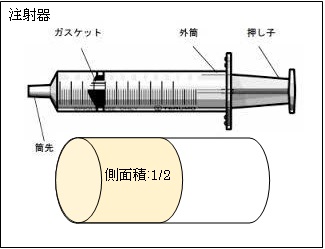
丂幚尡偱偼丄僺僗僩儞(拲幩婍)傪巊偄傑偡丅拲幩婍偱偼丄墴偟巕傪墴偟偰婥懱偺懱愊傪1/2攞偵埑弅偡傞偲丄昞柺愊傕栺1/2攞偲側傝傑偡丅
丂懱愊偑1/2攞偲側偭偰傕丄拲幩婍偺僔儕儞僟乕撪暻慡懱偑庴偗傞埑椡p偼曄傢傜側偄偺偱偡偑丄僔儕儞僟乕偺撪暻偺昞柺愊偼栺1/2攞偲側傞偺偱丄柺愊1[m2]摉偨傝偑庴偗傞埑椡p偼栺2攞偲側傝傑偡丅偟偨偑偭偰丄僈僗働僢僩偺晹暘偵妡傞埑椡(=墴偟巕偵妡傞椡)傕栺2攞偵側傝傑偡丅
丂偙偺巇慻傒偵傛傝丄拲幩婍撪偺婥懱偺懱愊V偑1/2攞偲側傞偲丄墴偟巕偑庴偗傞椡p偼栺2攞偲側傞偺偱
埑椡p亊懱愊V=堦掕抣
偲側傝傑偡丅偙傟傪乽儃僀儖偺朄懃乿偲尵偄傑偡丅
丂媡偵丄墴偟巕傪堷偄偰婥懱偺懱愊傪2攞偵朿挘偡傞偲丄
徴撍傑偱偺婥懱暘巕偺堏摦嫍棧r偼2攞偲側傝(枾搙偑1/2攞偲側傞偺偱丄徴撍偡傞妋棪偑1/2偲側傞偨傔)丄堏摦懍搙v偑丄寢榑偐傜尵偊偽(21/3)攞偲側傝傑偡丅偟偨偑偭偰
徴撍傑偱偵梫偡傞帪娫t=堏摦嫍棧r亐懍搙v=2亐(21/3)攞=2/(21/3)攞
偲側傝傑偡丅屘偵
婥懱暘巕摨巑偺徴撍昿搙p'[夞/s]=1亐2/(21/3)=(21/3)/2攞
偱偡丅偙偆偟偰
嘔婥懱暘巕摨巑偑徴撍偡傞僄僱儖僊乕U'=m亊v'2亊徴撍昿搙p'=m亊(22/3)亊(21/3)/2=m亊(23/3)/2=m[J]
偱丄懱愊傪2攞偵朿挘偟偰傕丄婥懱偺桳偡傞撪晹僄僱儖僊乕U偼曄壔偟傑偣傫丅偮傑傝丄僔儕儞僟乕撪暻慡懱偑庴偗傞埑椡p偼曄傢傝傑偣傫丅
丂墴偟巕傪堷偄偰僔儕儞僟乕撪偺婥懱偺懱愊傪2攞偵偡傞偲丄僔儕儞僟乕撪暻偺昞柺愊偼栺2攞偵側傝傑偡丅偱偡偐傜丄僔儕儞僟乕撪暻1[m2]摉偨傝偑庴偗傞埑椡p偼栺1/2攞偲側傝傑偡丅偟偨偑偭偰丄墴偟巕偑庴偗傞椡偼栺1/2攞偲側傝傑偡丅
丂偙偺働乕僗偱傕乽儃僀儖偺朄懃乿偑惉棫偟偰偄傑偡丅
嘨.抐擬曄壔
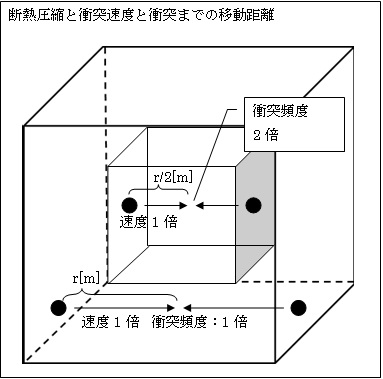
丂師偼丄嘇傪愢柧偟傑偡丅
丂忋婰嘆偺愢柧偼丄墴偟巕傪摦偐偟僔儕儞僟乕撪偺懱愊傪曄偊偨屻巄偔曻抲偟丄廃埻偺壏搙偲僔儕儞僟乕撪偺婥懱暘巕偑僄僱儖僊乕傪傗傝庢傝偟偨屻丄婥懱暘巕偺懍搙偑堦掕偵棊偪拝偄偨忬懺傪愢柧偟傑偟偨丅
丂崱搙偼丄廃埻偲偺僄僱儖僊乕偺傗傝庢傝傪晻偠抐擬偟偰僔儕儞僟乕撪偺懱愊傪曄偊偨帪偺丄埑椡p丒懱愊V丒愨懳壏搙T偺娭學傪峫嶡偟傑偡丅
丂愭偢丄墴偟巕傪弌棃傞偩偗懍偔墴偟丄僔儕儞僟乕撪偺婥懱偺懱愊V傪媫寖偵1/2攞偵埑弅偟傑偡丅
丂婥懱暘巕偺枾搙偑2攞偲側偭偨偺偱丄徴撍傑偱偵堏摦偡傞嫍棧r偼1/2攞偱偡丅婥懱偺堏摦懍搙v偼捈偖偵偼曄傢傝傑偣傫丅彮偟偺娫偼偦偺傑傑偱偡丅偱偡偐傜
婥懱暘巕偺徴撍偵梫偡傞帪娫t=r亐v=1/2亐1=1/2攞
偱偡丅偟偨偑偭偰
婥懱暘巕偺徴撍昿搙[夞/s]=1亐1/2=2攞
偲側傝傑偡丅屘偵
嘔婥懱暘巕摨巑偑徴撍偡傞僄僱儖僊乕U'=m亊v'2亊徴撍昿搙p'=m亊12亊2=2m[J]
偱丄婥懱偺桳偡傞撪晹僄僱儖僊乕U偼2攞偲側傝傑偡丅
丂偙偺條偵丄抐擬偟偰婥懱偺懱愊傪1/2攞偵偡傞偲丄僔儕儞僟乕撪暻慡懱偑庴偗傞埑椡p偼2攞偲側傝傑偡丅堦曽丄僔儕儞僟乕撪暻偺昞柺愊偼栺1/2攞偲側傞偺偱丄撪暻1[m2]摉偨傝偑庴偗傞埑椡偼4攞偲側傝傑偡丅偟偨偑偭偰丄僈僗働僢僩偺晹暘偵妡傞埑椡=墴偟巕偵妡傞椡傕栺4攞偲側傝傑偡丅
丂偙偺條偵丄抐擬偟偰懱愊傪1/2攞偵偡傞偲丄墴偟巕偵妡傞椡偼4攞偵側傝傑偡丅乽pV=nRT乿側偺偱
nRT=1/2亊4=2攞
偲側傝傑偡丅n偲R偼曄傢傜側偄偺偱丄愨懳壏搙T偑2攞偲側傝傑偡丅偙偺偲偍傝丄婥懱傪抐擬埑弅偡傞偲壏搙偑忋徃偟傑偡丅
丂媡偵丄抐擬偟偰墴偟巕傪堷偒僔儕儞僟乕撪偺懱愊傪2攞偵朿挘偡傞偲丄婥懱暘巕偺枾搙偑1/2攞偲側傞偺偱丄徴撍傑偱偵堏摦偡傞嫍棧r偼2攞偱偡丅婥懱偺堏摦懍搙v偼捈偖偵偼曄傢傝傑偣傫丅彮偟偺娫偼偦偺傑傑偱偡丅偱偡偐傜
婥懱暘巕偺徴撍偵梫偡傞帪娫t=r亐v=2亐1=2攞
偱偡丅偟偨偑偭偰
婥懱暘巕偺徴撍昿搙[夞/s]=1亐2=1/2攞
偲側傝傑偡丅屘偵
嘔婥懱暘巕摨巑偑徴撍偡傞僄僱儖僊乕U'=m亊v'2亊徴撍昿搙p'=m亊12亊1/2=1/2m
偱丄婥懱偺桳偡傞撪晹僄僱儖僊乕U偼1/2攞偲側傝傑偡丅
丂偙偺條偵丄抐擬偟偰婥懱偺懱愊傪2攞偵朿挘偡傞偲丄僔儕儞僟乕撪暻慡懱偑庴偗傞埑椡p偼1/2攞偲側傝傑偡丅堦曽丄僔儕儞僟乕撪暻偺昞柺愊偼栺2攞偲側傞偺偱丄撪暻1[m2]摉偨傝偑庴偗傞埑椡偼1/4攞偲側傝傑偡丅偟偨偑偭偰丄墴偟巕偵妡傞椡傕栺1/4攞偲側傝傑偡丅
丂偙偺帪丄乽pV=nRT乿側偺偱
nRT=2亊1/4=1/2攞
偲側傝傑偡丅n偲R偼曄傢傜側偄偺偱丄愨懳壏搙T偼1/2攞偲側傝傑偡丅偙偺偲偍傝丄婥懱傪抐擬朿挘偡傞偲壏搙偑掅壓偟傑偡丅
嘩.棻巕偺幙検偺塭嬁
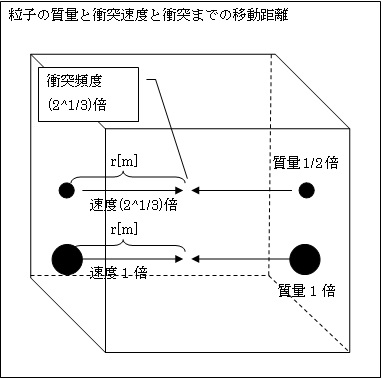
丂師偼丄嘊婥懱暘巕偺幙検偑1/2攞偲側偭偨応崌傪峫嶡偟傑偡丅
丂寢榑偐傜尵偆偲丄婥懱暘巕偺懍搙v偼(21/3)攞偵側傝傑偡丅
丂徴撍傑偱偵堏摦偡傞嫍棧r偼偦偺傑傑偺1攞偱偡丅偱偡偐傜
婥懱暘巕偺徴撍偵梫偡傞帪娫t=r亐v=1亐(21/3)=1/(21/3)攞
偱偡丅偟偨偑偭偰
婥懱暘巕偺徴撍昿搙[夞/s]=1亐1/(21/3)= (21/3)攞
偲側傝傑偡丅
丂屘偵
嘔婥懱暘巕摨巑偑徴撍偡傞僄僱儖僊乕U'=m亊v'2亊徴撍昿搙p'=1/2亊(22/3)亊(21/3)= (23/3)/2=1攞
偱偡丅偙偺偲偍傝丄婥懱偺桳偡傞撪晹僄僱儖僊乕U偼丄婥懱暘巕偺幙検傪1/2攞偡傞慜偲摨偠偱偡丅
丂拲幩婍偺僔儕儞僟乕撪暻偺柺愊傕丄偦偺撪暻慡懱傪墴偡埑椡p傕曄傢傜側偄偺偱丄婥懱暘巕偺幙検m偑1/2攞偵側偭偰傕丄墴偟巕傪墴偡椡p偼曄傢傝傑偣傫丅偟偨偑偭偰丄婥懱暘巕1屄偺幙検m偑曄傢偭偰傕丄埑椡p丒懱愊V丒愨懳壏搙T偵曄壔偼偁傝傑偣傫丅
嘪.婥懱暘巕偺検偺塭嬁
丂師偼丄嘋偱偡丅偙偺婥懱棻巕偺悢n偑2攞偲側偭偨忬懺偼丄n傪堦掕偵偟偰婥懱偺懱愊傪1/2攞偲偟偨偺偲摨偠忬懺偱偡丅偱偡偐傜丄嘆偺愢柧偺偲偍傝偱偡丅
嘫.愨懳壏搙偺塭嬁
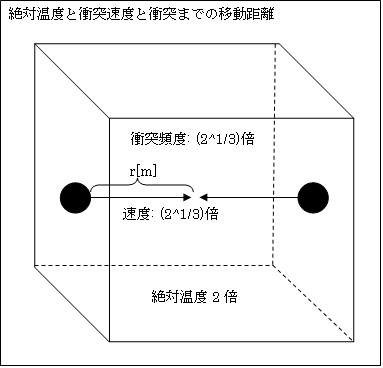
丂師偼丄嘍偱偡丅愨懳壏搙傪2攞偵偟偰丄婥懱暘巕偵梌偊傞塣摦僄僱儖僊乕傪2攞偵偡傞偲丄寢榑偐傜尵偊偽偦偺堏摦懍搙v偼(21/3)攞偲側傝傑偡丅
丂徴撍傑偱偵堏摦偡傞嫍棧r偼偦偺傑傑偱偡丅偱偡偐傜
婥懱暘巕偺徴撍偵梫偡傞帪娫t=r亐v=1亐(21/3)=1/(21/3)攞
偱偡丅偟偨偑偭偰
婥懱暘巕偺徴撍昿搙[夞/s]=1亐1/(21/3)= (21/3)攞
偲側傝傑偡丅屘偵
嘔婥懱暘巕摨巑偑徴撍偡傞僄僱儖僊乕U'=m亊v'2亊徴撍昿搙p'=1亊(22/3)亊(21/3)= (23/3)=2攞
偲側傝傑偡丅偙偺偲偍傝丄婥懱偺桳偡傞撪晹僄僱儖僊乕U偼2攞偲側傝傑偡丅
丂僔儕儞僟乕撪暻慡懱傪墴偡埑椡p偑2攞偵側傝傑偟偨丅婥懱偺懱愊傪曄偊側偗傟偽丄僔儕儞僟乕偺撪暻1[m2]摉偨傝偵妡傞埑椡偼2攞偵側傝丄墴偟巕傪墴偡椡傕2攞偲側傝傑偡丅
丂墴偟巕傪墴偡椡p傪摨偠偵偡傞偼丄懱愊傪2攞偵偟僔儕儞僟乕撪暻偺昞柺愊傪栺2攞偵偟側偗傟偽側傝傑偣傫丅
丂偮傑傝
2nRT=2p亊V=p亊2V=2pV
偱偡丅
丂偙偺巇慻傒偵傛傝乽埑椡亊懱愊=婥懱偺検亊婥懱掕悢亊愨懳壏搙乿偮傑傝乽pV=nRT乿偲側傝傑偡丅埲忋偺愢柧傪乽棟憐婥懱忬懺曽掱幃偺kothimaro夝朄乿偲屇傃傑偡(2016/09/23AM5:53)丅
 丂偦傟偵斾傋偰丄惓榋柺懱偺拞偺枾晻偝傟偨婥懱暘巕偼丄懠偲傇偮偐傝側偑傜忋壓嵍塃慜屻偵寖偟偔堏摦偟傑偡丅婥懱暘巕摨巑偑旕抏惈徴撍偡傞偺偱丄婥懱暘巕偑帩偭偰偄偨椡妛揑僄僱儖僊乕偺堦晹偼丄擬僄僱儖僊乕偵曄傢傝傑偡丅偦偟偰丄幐傢傟傞椡妛揑僄僱儖僊乕偼徴撍帪偺懍搙偺2忔偵斾椺偟偰懡偔側傝傑偡丅
丂偦傟偵斾傋偰丄惓榋柺懱偺拞偺枾晻偝傟偨婥懱暘巕偼丄懠偲傇偮偐傝側偑傜忋壓嵍塃慜屻偵寖偟偔堏摦偟傑偡丅婥懱暘巕摨巑偑旕抏惈徴撍偡傞偺偱丄婥懱暘巕偑帩偭偰偄偨椡妛揑僄僱儖僊乕偺堦晹偼丄擬僄僱儖僊乕偵曄傢傝傑偡丅偦偟偰丄幐傢傟傞椡妛揑僄僱儖僊乕偼徴撍帪偺懍搙偺2忔偵斾椺偟偰懡偔側傝傑偡丅 丂偙偙偱丄惓榋柺懱偺梕婍偺懱愊傪1/2攞偵偟傑偡丅偡傞偲丄婥懱暘巕偑懠偲徴撍傑偱偵堏摦偡傞嫍棧傕1/2攞偲側傝傑偡丅婥懱暘巕偺枾搙偑2攞偲側傞偺偱丄徴撍偡傞妋棪傕2攞偲側傞偐傜偱偡丅
丂偙偙偱丄惓榋柺懱偺梕婍偺懱愊傪1/2攞偵偟傑偡丅偡傞偲丄婥懱暘巕偑懠偲徴撍傑偱偵堏摦偡傞嫍棧傕1/2攞偲側傝傑偡丅婥懱暘巕偺枾搙偑2攞偲側傞偺偱丄徴撍偡傞妋棪傕2攞偲側傞偐傜偱偡丅 丂偱偼丄偙偺帪埑椡p偼壗攞偲側傞偱偟傚偆偐丅
丂偱偼丄偙偺帪埑椡p偼壗攞偲側傞偱偟傚偆偐丅



